Impacto de la valoración no invasiva en la cirrosis hepática
Se considera que la fibrosis hepática es el resultado final de todas las injurias que afronta la glándula hepática, basada en una respuesta única contra insultos tales como son las hepatitis virales crónicas, hepatitis alcohólicas, esteatohepatitis no alcohólica, hemocromatosis, o hepatitis autoinmune que producen daño del hepatocito…
Impact of the non-invasive markers in to the hepatic cirrhosis
Dr. Alfredo Arredondo Bruce. MSc. Especialista de segundo grado en Medicina Interna. Profesor Auxiliar.
Resumen
Introducción. Se considera que la fibrosis hepática es el resultado final de todas las injurias que afronta esta glándula, si continua el daño esta fibrosis inexorablemente evolucionara a una cirrosis hepática. La biopsia hepática considerada la “regla de oro” para evaluar la fibrosis hepática, ha perdido fiabilidad, debido a errores de la muestra, y discrepancias entre diferentes observadores, para superar todos estos problemas se han desarrollado varios sistemas no invasivos para evaluar la fibrosis hepática.
Material y métodos. Se realizó un estudio explicativo transversal, de la aplicación de dos sistemas de determinación de fibrosis hepática, y cronicidad, en un universo formado por todos los pacientes fallecidos por cirrosis hepática, durante los años 2010-2011 en el Hospital “Amalia Simoni”, la muestra estará dada por todos los pacientes que presenten en su historia clínica los estudios complementarios necesarios, para determinar ambos índices, APRI y el AAR, los resultados se expresan en tablas para su discusión y obtención de resultados.
Discusión y resultados. Existió un predomino de la edad en dos momentos en la 4ª y 6ª década, el sexo masculino, alta incidencia de Cirrosis alcohólica y una efectiva correlación con los sistemas propuestos.
Conclusiones. La cirrosis hepática es una entidad frecuente que aparece pacientes me mediana edad, estando muy relacionada al alcoholismo en nuestro universo, con una excelente correlación con los sistemas no invasivos de tipo APRI y AAR.
Palabras clave. Cirrosis hepática, fibrosis, alcoholismo, sistemas no invasivos, APRI, AAR.
Introduction. The hepatic fibrosis is the final result of all the insults that confronts the hepatic gland, if continuous the damage this fibrosis inexorably evolved to a liver cirrhosis. The considered hepatic biopsy the «gold standard» to evaluate the hepatic fibrosis, it has lost reliability, due to errors of the sample, and discrepancies among different observers, to overcome all these problems several non-invasive markers they have been developed to evaluate the hepatic fibrosis.
Material and methods. The explanatory transversal study was carried out, with the application of two systems of determination of hepatic fibrosis, and chronicity, in an universe formed by all the patients died by hepatic cirrhosis, during the years 2010- 2011 in the «Amalia Simoni» Hospital, the sample will be given by all the patients that present in its clinical history the necessary complementary studies, to determine both indexes. APRI and the AAR, the results are expressed in charts for their discussion and obtaining of results.
Discussion and results. The prevalent age was in two moments, at 4ª and 6ª decade, the male sex, with high incidence of alcoholic cirrhosis and an effective correlation with the proposed systems.
Conclusions. The liver cirrhosis is a frequent entity that appears adult bearing of the life, being very related to the alcoholism in our universe, with a excellent correlation with the non-invasive markers APRI and AAR.
Key words. Liver cirrhosis, fibrosis, alcoholism, non-invasive markers, APRI and AAR
Introducción.
Se considera que la fibrosis hepática es el resultado final de todas las injurias que afronta la glándula hepática, basada en una respuesta única contra insultos tales como son las hepatitis virales crónicas, hepatitis alcohólicas, esteatohepatitis no alcohólica, hemocromatosis, o hepatitis autoinmune que producen daño del hepatocito, la cual está basada fundamentalmente en la proliferación, y en la deposición anormal de la matriz extracelular (ECM). (1) Si después de este daño original continúan las injurias contra el parénquima hepático, esta fibrosis inexorablemente evolucionara hacia la cirrosis hepática. (1,2)
Debido a las posibles complicaciones a que puede llevar la cirrosis hepática, y a la amenaza a la vida que esta conlleva, se hace necesario la valoración exacta de la fase fibrótica donde se encuentra la enfermedad, lo cual es de extrema importancia para el tratamiento de los pacientes con enfermedad crónica del hígado. La biopsia hepática considerada la “regla de oro” para evaluar la fibrosis hepática, (2,3) tiene un carácter invasivo y las complicaciones a que puede llevar, raras pero graves, (3,4) junto a su dudosa fiabilidad, tanto en la toma de muestra, el tamaño de la misma, el lugar del órgano donde fue tomada, (5-9) las diferentes coloraciones y las divergencias de diferentes observadores han hecho discutible el valor de esta prueba. (9-11)
Para superar todos estos problemas asociados con la biopsia hepática, se han desarrollado varios sistemas no invasivos para evaluar el estado de la fibrosis a través de marcadores sanguíneos. (12,13) Recientes estudios han propuesto varios parámetros que incluyen marcadores sanguíneos de uso común como son la aminotransferasa de la aspartasa (AST), alanino aminotransferasa, (ALT), la proporción ALT/AST (AAR), (14) el tiempo de protrombina (PT), LA gamma-glutamil transpeptidasa (GGT), el índice (PGA) apolipoproteina-A1 (Apo-A1), (15) PT, GGT, índice Apo-A1, α2-macroglobulina (PGAA), (1,3) el FibroTest (Biopredictive, París, France),(12) el índice de proporción de edad/plaqueta (API), (16) el índice de fibrosis de Forn (FFI), (17) el índice de proporción de AST con el conteo de plaquetas (APRI), (18) el índice discriminativo de cirrosis: (CDS) conteo de plaqueta, AST, ALT, la proporción normalizada internacional (INR),(19) y el modelo de Hui et al. (20) Otros estudios han sugerido varios marcadores de suero como los siguientes, el colágeno, el ácido del hialurónico, YKL-40, las metaloproteinasa de la matriz (MMP), e inhibidor del tejido de metaloproteinasa (TIMP), los cuales han presentado potencialidades para medir la acumulación o degradación de la matriz extracelular (ECM). (14, 21,22) Cuadro 1
En este trabajo pretendemos correlacionar los marcadores APRI y AAR con los pacientes diagnosticados de cirrosis hepática, por estudio anátomo-patológico (necrópsico) durante dos años en el Hospital Clínico Quirúrgico Docente ”Amalia Simoni” de la ciudad de Camagüey.
Material y métodos.
Se realizó una investigación en desarrollo basada en un estudio explicativo transversal, de la aplicación de dos sistemas de determinación de fibrosis hepática, y cronicidad, en un universo formado por todos los pacientes fallecidos por cirrosis hepática, durante los años 2010 y 2011 en el Hospital “Amalia Simoni”, la muestra estuvo dada por todos los pacientes diagnosticados por estudio autópsico de cirrosis hepática de cualquier etiología, y que tuvieran realizado en su historia clínica los estudios complementarios necesario para determinar ambos índices. Los diferente índices se realizaron de la siguiente forma; índice de proporción de AST con el conteo de plaquetas (APRI), (18) AST/Limite superior de AST/ el conteo de plaquetas por 109 multiplicado por 100, el cual se evaluó. 0,5 o menos cirrosis hepática, hasta 0,3 fibrosis marcada, de 0,3 hasta 1,5 fibrosis moderadas y más de 1,5 fibrosis ligeras, y el AAR (14) AST/ALT para determinar cronicidad, se evaluó, si mayor de 1 cronicidad y menor de 1 no enfermedad crónica, estos resultados conformaron la base de datos necesaria para poder comparar estos índices no invasivos contra el estudió histológico logrado por necropsia, los resultados se expresan en tablas para su discusión y obtención de resultados.
Discusión y resultados.
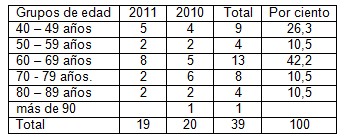
En este estudio, al analizar la tabla 1 se observa una prevalencia en la edad de 60 a 69 años, lo cual está sustentado por la evolución crónica de esta enfermedad, en la cual se debe ingerir bebidas alcohólicas diariamente a dosis elevadas durante más de 20 años, o sufrir una enfermedad hepática crónica, infecciosa o no, por un largo periodo de tiempo, pero aquí también hay otra elevación entre los 40 a 49 años, sugiriendo que la agresión al parénquima hepático surgió en la década de los 20 años de edad, de inicio muy prematuro en la adolescencia o juventud temprana.
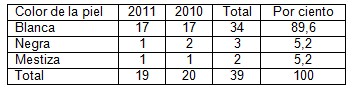
La tabla dos muestra el predominio del color blanco de la piel, que es secundario a la distribución racial de nuestra provincia, aunque existen estudios en América latina y EE UU, donde se ha encontrado una mayor relación entre cronicidad en las enfermedades hepáticas como son; el hígado graso no alcohólico y las infecciones B y C en blancos hispano, superando a los caucásicos y afroamericanos. (23)
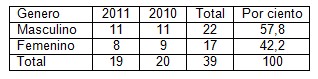
Como es de pensar en la tabla tres predomina el sexo masculino al ser el más adicto al alcohol, y las hepatopatías virales crónicas, no obstante los dos casos secundarios a hepatitis C y la biliar primaria, que se describirán a continuación fueron del sexo femenino, sin embargo también es de notar en esta tabla que la aparición de cirrosis hepática en el género femenino no es despreciable y va en aumento a nivel mundial y en nuestra sociedad. (23,24)
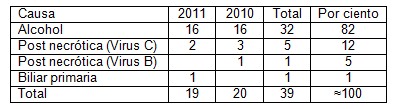
En la tabla cuatro se muestra predominio de la cirrosis alcohólica es de un 82% aproximadamente, muy superior a las otras causas, incluyendo la hepatitis C de la cual encontramos cinco casos y uno de la B, sugiriendo este estudio la posibilidad de una alta incidencia de alcoholismo en la muestra estudiada, sobre la hepatitis C, y el hígado graso no alcohólico que es la causa más importante en otros países. (23)
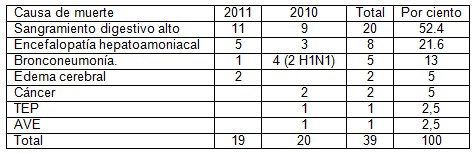
Como era de esperar en la tabla cinco, donde aparecen las causas de muerte, se puede observar el predominio del sangramiento digestivo secundario a hipertensión portal y varices esofágicas, quedando en un segundo nivel la encefalopatía hepato amoniacal, como una complicación neurológica de la insuficiencia hepática, la neumopatía inflamatoria como causa de muerte aparece en el 13% de los pacientes secundario a la depresión inmunológica que ocurre en esta enfermedad, apareciendo como algo interesante dos casos por virus H1N1 durante la epidemia que azotó nuestra provincia, todo esto debido a las alteraciones de la inmunidad que aparece en la cirrosis, el cáncer apareció en solo dos casos posiblemente por el corto tiempo transcurrido desde el diagnóstico de cirrosis y el fallecimiento del enfermo.
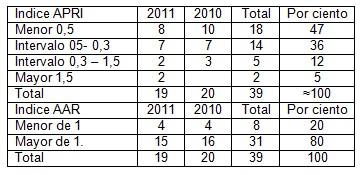
En esta importantísima sexta tabla podemos observar que el sistema APRI detectó cirrosis y fibrosis severa en 32 casos para un 82% de coincidencia entre ambas pruebas, muy elevado si se tiene en cuenta que estamos comparando con material de autopsia y no biopsia, y en solo 2 casos no coincidió con el diagnóstico anátomo-patológico, es de señalar que los resultados histológicos se obtenidos por necropsia y no biopsia, aportan una mayor seguridad histológica al poder superar las dificultades con la toma de muestra, alcanzando así una mayor efectividad desde el punto de vista anatómico.
En el sistema AAR, igualmente el índice menor de 1 prevaleció en un 80%, lo cual nos da una gran seguridad de que estos casos, al aplicarse un estudio no invasivo hubiera existido una elevada correlación con la fibrosis severa o cirrosis y con la cronicidad de la enfermedad. (1)
Conclusiones.
La cirrosis hepática es una entidad frecuente como causa de muerte en el Hospital Amalia Simoni, donde se vio una doble alza en la edad entre los 40 a 49 años y después de los 60 años, al igual que el predominio del sexo masculino, lo cual puede estar en relación con la ingestión precoz y exagerada de bebidas alcohólicas, que comenzaría en edades precoces, y con elevación discreta de la mujer. Esto es demostrado contundentemente por el alto número de cirrosis alcohólicas, diferente a otras naciones donde la causa fundamental es la hepatitis C y el hígado graso no alcohólico.
Finalmente la correlación entre los sistemas no invasivos, y el diagnóstico post mortem demuestran una íntima relación, tanto en concordancia con la fibrosis mostrada por el sistema APRI, como con el estado de cronicidad aportado por el sistema AAR, lo que hace que este estudio aunque preliminar, demuestre la alta relación existente entre el diagnóstico de la cirrosis hepática por sistemas no invasivos, y el diagnóstico histológico por necropsia, el cual es aun más exacto que la biopsia.
Tabla 1. Distribución según grupos de edades.
Fuente. Protocolos de necropsia.
Tabla 2. Distribución según color de la piel.
Fuente. Protocolos de necropsia.
Tabla 3. Distribución según sexo.
Fuente. Protocolos de necropsia.
Tabla 4. Distribución etiológica.
Fuente. Protocolos de necropsia.
Tabla 5. Distribución según causa de muerte.
Fuente. Protocolos de necropsia.
Tabla 6. Aplicación de los sistemas no invasivos APRI.
Fuente. Historias clínicas.
Cuadro 1. Algunos de los modelos predictivos para el estudio del hígado en las hepatopatías crónicas
Sistemas no invasivos – Componentes
AAR: AST/ALT
Índice PGA:
1. PT (% of control): ≥ 80 = 0; 70–79 = 1; 60–69 = 2; 50–59 = 3; < 50 = 4
2. GGT (IU/L): < 20 = 0; 20–49 = 1; 50–99 = 2; 100–199 = 3; ≥ 200 = 4
3. Apo-A1 (mg/dL): ≥ 200 = 0; 175–199 = 1; 150–174 = 2; 125–149 = 3; < 125 = 4
PGA índice la suma de lo superior
Índice PGAA:
1. PT (% of control): ≥ 80 = 0; 70–79 = 1; 60–69 = 2; 50–59 = 3; < 50 = 4
2. GGT (IU/L): < 20 = 0; 20–49 = 1; 50–99 = 2; 100–199 = 3; ≥ 200 = 4
3. Apo-A1 (mg/dL): ≥ 200 = 0; 175–199 = 1; 150–174 = 2; 125–149 = 3; < 125 = 4
4. α2-Macroglobulina (g/L): < 1.25 = 0; 1.25–1.74 = 1; 1.75–2.24 = 2; 2.25–2.74 = 3; ≥ 2.75 = 4
PGAA index is the sum of the above.
Índice FFI:
FFI = 7.811–3.131* ln(Conteo de plaquetas 09/L]) + 0.781*ln(GGT[IU/L]) + 3.467*en (edad[años])—0.014*ln(colesterol[mg/dL])
Sistema APRI:
APRI = (AST/ULN)/plaquetas [*109/L])*100
Sistema API:
1. Edad (años): < 30 = 0; 30–39 = 1; 40–49 = 2; 50–59 = 3; 60–69 = 4; ≥ 70 = 5
2. Conteo de plaquetas (*109/L): ≥ 225 = 0; 200–224 = 1; 175–199 = 2; 150–174 = 3; 125–149 = 4; < 125 = 5
AP índice de suma superior.
Sistema CDS:
1. Conteo de plaquetas (*109/L):> 340 = 0; 280–339 = 1; 220–279 = 2; 160–219 = 3; 100–159 = 4; 40–49 = 5; < 40 = 6
2. AST/ALT ratio: > 1.7 = 0; 1.2–1.7 = 1; 0.6–1.19 = 2; < 0.6 = 3
INR: < 1.1 = 0; 1.1–1.4 = 1; > 1.4 = 2.
Modelo Hui’s:
Exp(3.148 + 0.167*BMI + 0.088*bilirrubina[mm]-0.151*albumina[g/L]
−0.019*plaquetas[109/L])/(1 + exp[3.148 + 0.167*BMI + 0.088*bilirrubina[mm]
−0.151*albumina[g/L]-0.019*plaquetas[109/L]])
AAR, AST/ALT ratio; ALT, alanino aminotransferasa; API, Índice edad- plaquetas; Apo-A1, apolipoproteína-A1; APRI, AST/UNL de AST/ conteo de plaquetas/100 ; AST, aspartato aminotransferasa; BMI, índice de masa corporal; CDS, índice discriminativo de cirrosis; FFI, Índice de fibrosis Forn; GGT, gamma-glutamil transpeptidasa; INR, radio internacional normalizado; PGA, tiempo de protrombina, GGT, apolipoproteína-A1; PGAA, protrombina, GGT, apolipoproteína-A1, α2-macroglobulina; PT, tiempo de protrombina; UNL, Límite superior de lo normal.
Referencias bibliográficas.
1. Germani, G.; Hytiroglou, P.; Fotiadu, A.; Burroughs,A.; Dhillon, A. Assessment of Fibrosis and Cirrhosis in Liver Biopsies An Update. Semin Liver Dis. 2011;31(1):82-90.
2. Udell JA, Wang CS, Tinmouth J, FitzGerald JM, Ayas NT, Simel DL. Does this patient with liver disease have cirrhosis? JAMA. 2012;307(8):832-42.
3. Dienstag JL. The role of liver biopsy in chronic hepatitis C. Hepatology 2002; 36: S152–60.
4. Cadranel JF, Rufat P, Degos F. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF). Hepatology 2000; 32: 477–81.
5. Bravo AA, Sheth SG, Chopra S. Liver biopsy. N. Engl. J. Med. 2001; 344: 495–500.
6. Colloredo G, Guido M, Sonzogni A, Leandro G. Impact of liver biopsy size on histological evaluation of chronic viral hepatitis: the smaller the sample, the milder the disease. J. Hepatol. 2003; 39: 239–44.
7. Bedossa P, Dargere D, Paradis V. Sampling variability of liver fibrosis in chronic hepatitis C. Hepatology. 2003; 38: 1449–57.
8. Siddique I, El-Naga HA, Madda JP, Memon A, Hasan F. Sampling variability on percutaneous liver biopsy in patients with chronic hepatitis C virus infection. Scand. J. Gastroenterol. 2003; 38: 427–32.
9. Maharaj B, Maharaj RJ, Leary WP. Sampling variability and its influence on the diagnostic yield of percutaneous needle biopsy of the liver. Lancet 1986; 1: 523–5.
10. Regev A, Berho M, Jeffers LJ. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am. J. Gastroenterol. 2002; 97: 2614–8.
11. Wanless IR. Vascular disorders. In: Burt AD, Portmann BC, Ferrell LD eds. MacSween’s Pathology of the Liver. 5th ed. Philadelphia: Churchill Livingstone; 2007:613–48
12. Garcia-Tsao G, Friedman S, Iredale J, Pinzani M. Now there are many (stages) where before there was one: In search of a pathophysiological classification of cirrhosis. Hepatology 2010;51(4):1445–9
13. Fontana RJ, Goodman ZD, Dienstag JL. HALT-C Trial Group. Relationship of serum fibrosis markers with liver fibrosis stage and collagen content in patients with advanced chronic hepatitis C. Hepatology 2008;47(3): 789–98
14. Patel K, Muir AJ, McHutchison JG. Validation of a simple predictive model for the identification of mild hepatic fibrosis in chronic hepatitis C patients. Hepatology. 2003; 37: 1222-3
15. Giannini EG, Zaman A, Ceppa P, Mastracci L, Risso D, Testa R. A simple approach to noninvasively identifying significant fibrosis in chronic hepatitis C patients in clinical practice. J. Clin. Gastroenterol. 2006; 40: 521–7.
16. Sebastiani G, Vario A, Guido M, Alberti A. Sequential algorithms combining non-invasive markers and biopsy for the assessment of liver fibrosis in chronic hepatitis B. World J. Gastroenterol. 2007; 13: 525–31.
17. Cales P, de Ledinghen V, Halfon P. Evaluating the accuracy and increasing the reliable diagnosis rate of blood tests for liver fibrosis in chronic hepatitis C. Liver Int. 2008; 28: 1352–62.
18. Germani G, Burroughs AK, Dhillon AP. The relationship between liver disease stage and liver fibrosis: a tangled web. Histopathology 2010;57(6):773–84
19. Castera L, Forns X, Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol 2008; 48(5):835–47
20. Burroughs AK, Thalheimer U. Hepatic venous pressure gradient in 2010: optimal measurement is key. Hepatology 2010;51(6):1894–6
21. Manousou P, Burroughs A, Isgro G. Computer assisted image analysis of liver collagen at one year biopsy can predict clinical outcome in HCV post LT patients. Hepatology 2009;50(S4):302A–3A
22. Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology 2008;134(6):1655–69
23. Arredondo B A. Guerrero JG. Las hepatopatías crónicas en el contexto latinoamericano. Portalesmedicos. 2012; Vol VII. No.4 febrero 2012. Disponible en: www.portalesmedicos.com
24. Yang AL, Vadhavkar S, Sing G. Epidemiology of alcohol-related liver and pancreatic disease in the United States. Arch Intern Med 2008;168:649–56.