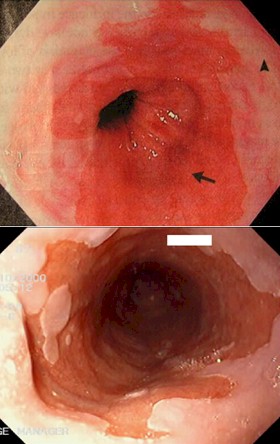
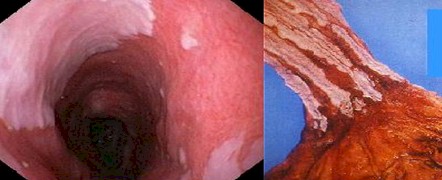
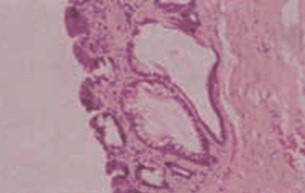
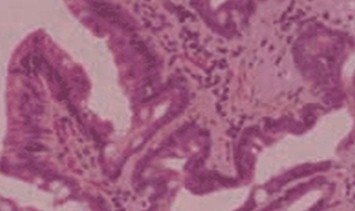
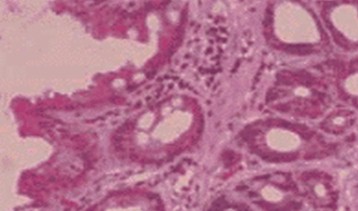
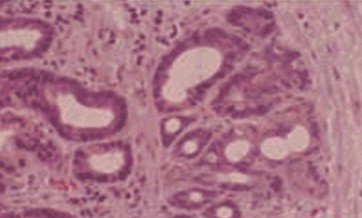
Diagnóstico histológico:
Últimamente tiende a definirse el esófago de Barret como la presencia de mucosa columnar con metaplasia intestinal en el esófago inferior. La importancia de este cambio en la definición, es que la metaplasia de Barret se ha convertido así en un criterio histológico más que endoscópico, ya que sólo sería posible identificar la metaplasia intestinal mediante el estudio histopatológico.
A nivel microscópico, como ya mencionamos, pueden identificarse tres tipos de epitelio de Barret: gástrica, transicional e intestinal. Hasta el 90% de los Adenocarcinomas Esofágicos que se desarrollan sobre un Esófago de Barret, se originan en una metaplasia intestinal. Afortunadamente, sólo el 3-5% de los pacientes con enfermedad por reflujo gastroesofágico (ERGE) tiene Esófago de Barret con metaplasia intestinal.
Siguiendo la evolución natural del esófago de Barret al Adenocarcinoma se pueden evidenciar distintos patrones histológicos:
• Metaplasia intestinal sin displasia: es el epitelio columnar «intestinalizado» (completo o incompleto) semejando la mucosa intestinal con criptas y superficie vellosa. El tipo incompleto contiene células caliciformes productoras de mucina ácida, con citoplasma basofílico, con núcleos homogéneos que yacen cerca de la membrana basal, dispersas entre células epiteliales columnares mucinosas en la superficie y un epitelio glandular que semeja la arquitectura normal glandular foveolar gástrica. Las células caliciformes están distendidas por la mucina ácida que comprime el núcleo hacia la base. La metaplasia intestinal completa es menos frecuente y está compuesta por células columnares absortivas maduras con un ribete en cepillo bien formado y células caliciformes.
Metaplasia intestinal sin displasia.
• Displasia: se define como una proliferación neoplásica inequívoca, de carácter benigno sin capacidad de metastatizar, esencialmente equivalente a un adenoma. Se clasifica en las siguientes categorías:
a) Indefinido para displasia: cuando no hay seguridad de afirmar la presencia o ausencia de displasia en forma inequívoca. Se encuentran cambios regenerativos o inflamación aguda. Puede encontrarse cambios citológicos sugerentes de displasia en la profundidad del tejido (hipercromasia nuclear y mitosis aumentadas), pero madurez tisular en la superficie y conservación de la arquitectura glandular epitelial. La pérdida de la polaridad nuclear apunta fuertemente hacia displasia.
b) Displasia de bajo grado: se caracteriza por arquitectura glandular conservada, aumento del número y del tamaño de los núcleos, los que suelen estar alargados y estratificados hasta los dos tercios, pero sin alcanzar el tercio o polo luminal de las células y sin perder su posición perpendicular a la membrana basal. Presenta hipercromasia nuclear, presencia de mitosis sin características atípicas y disminución de la cantidad de mucina citoplasmática.
Metaplasia intestinal con displasia de bajo grado.
c) Displasia de alto grado: Hay distorsión arquitectural con ramificación de las glándulas, emisión de yemaciones, transformación vellosa de la superficie mucosa, puentes epiteliales intraglandulares y agrupación compacta de las glándulas. Se observa marcado aumento del número y tamaño de núcleos que son pleomórficos, de contornos irregulares y se observa también hipercromasia nuclear. Además hay marcada estratificación nuclear con pérdida de la polaridad nuclear y muchos de los núcleos alcanzan el polo luminal. La mitosis es más numerosa y aparición de mitosis atípicas. Se aprecia nucléolos prominentes. Habitualmente no hay secreción de mucina. Se le considera una neoplasia intraepitelial al no comprometer la lámina propia.
Metaplasma intestinal con displasia de alto grado.
• Adenocarcinoma: a los cambios anteriores se agrega pérdida completa de la arquitectura glandular e invasión de la lámina propia.
Adenocarcinoma bien y moderadamente diferenciado.
El diagnóstico depende de la conjunción de criterios endoscópicos e histológicos. Ha evolucionado desde la exigencia de una extensión variable y arbitraria (mayor de 2-5 cm) de epitelio columnar por encima de la unión gastroesofágica, hasta aceptar como diagnostica la presencia de cualquier extensión de epitelio columnar de tipo intestinal por encima de la misma.
Indicadores de riesgo para cáncer:
1. Displasia. La displasia epitelial es lo que mejor indica el riesgo de desarrollar Adenocarcinoma. El grado histológico de displasia es, normalmente, el parámetro más importante usado en el seguimiento de los pacientes con esófago de Barret.
La displasia severa puede ser confundida con un carcinoma “in situ”, por lo que su detección en una muestra de biopsia, obliga a repetir la endoscopía con toma de múltiples muestras con el objeto de descartar un carcinoma coexistente. Hay que subrayar que la progresión del esófago de Barret a carcinoma no es obligatoria y que, incluso, cuando se desarrolla una displasia puede permanecer estable y, para algunos, hasta regresar.
2. Longitud del segmento de epitelio metaplásico. Todos los pacientes con esófago de Barret deben considerarse de mayor riesgo de malignización, ya que la displasia puede aparecer independientemente de la longitud que tenga el segmento de epitelio columnar metaplásico. Pero se considera que la mayor extensión del segmento metaplásico indica una mayor agresividad del material refluido y/o un mayor tiempo de contacto del mismo con la mucosa esofágica; por lo que los pacientes con una extensión de la metaplasia gástrica de 5 cm o más, deben incluirse en el grupo de riesgo medio.
3. Esofagitis crónica. La esofagitis crónica, debida a la persistencia de la enfermedad por reflujo gastroesofágico (ERGE), ha sido implicada como causa del desarrollo de displasia y posterior Adenocarcinoma. La esofagitis crónica y la mayor longitud del segmento esofágico metaplásico son dos circunstancias que responden a la misma causa. Estas dos situaciones son independientes a la sintomatología del paciente, es decir, éste puede presentar o no síntomas de enfermedad por reflujo gastroesofágico (ERGE). En los pacientes oligo o asintomáticos, por la irritación más intensa y/o más continua que se produce sobre la mucosa esofágica, es lógico el desarrollo de fenómenos reparativos, que lleven a esófago de Barret y puedan conducir a una “inestabilidad” genómica, que sea el inicio del camino hacia la malignidad.
4. Factores ambientales. El papel de los factores ambientales en la progresión de la displasia a Adenocarcinoma es mal conocido. El tabaco y el alcohol, han sido estudiados ampliamente en su papel como agentes etiológicos del esófago de Barret, pero existen pocas investigaciones sobre su papel en el desarrollo de displasia y Adenocarcinoma. Al parecer no hay relación directa entre estos tóxicos con la longitud de la metaplasia ni con la existencia de displasia o cáncer. Sin embargo, ambos tóxicos, al disminuir el tono del esfínter esofágico inferior, favorecen el enfermedad por reflujo gastroesofágico (ERGE) y por lo tanto sus consecuencias.
5. Otros marcadores de riesgo de cáncer. No existen otros marcadores que puedan remplazar al marcador preneoplásico por excelencia que es la displasia. Sin embargo, en la evolución desde el tejido normal hacia la displasia leve y luego severa, se detectan una serie de cambios en la célula que, en cierta forma, pueden ayudar a identificar grupos de alto riesgo de cáncer, para poder realizar en ellos un seguimiento diferenciado. Estas modificaciones celulares son las siguientes:
o Incremento de la cantidad de DNA nuclear de las células epiteliales (aneuploidía).
o Aumento de la proporción de células que están entrando en las fases G1, S y G2 del ciclo celular; lo que significa un aumento en la tasa de mitosis.
o Expresión de oncogenes y sus productos: proteína p53, C-erb2, PCNA (Antígeno de Proliferación Nuclear Celular) y CEA (Antígeno Carcino Embrionario).
o Anormalidades cromosómicas: detección del gen p53, APC (gen de la Poliposis Adenomatosa), etc.
o Cambios en la composición de las mucinas: con las técnicas histoquímicas usuales se pueden distinguir 3 tipos de mucinas: neutras, sialomucinas y sulfomucinas.
La mayoría de los marcadores tumorales, distintos de la displasia, no deben emplearse de forma rutinaria en la clínica diaria para el estudio de estos pacientes. Actualmente son objeto de investigación para intentar conocer mejor la historia natural de este proceso hacia la malignización y para marcar, en un futuro, pautas para llegar a un diagnóstico precoz en período útil.
Seguimiento endoscópico- biópsico:
La vigilancia endoscópica en el esófago de Barret se encuentra dirigida primariamente a la búsqueda de cambios displásicos para que la resección de este epitelio mediante algún método impida el desarrollo de una neoplasia. Desdichadamente el grado de displasia puede afectarse en su interpretación aún cuando morfológicamente existen criterios para graduarla, debido al grado de regeneración de la mucosa como respuesta al daño inflamatorio.
La detección precoz de malignidad es deseable, ya que las posibilidades de curación del adenocarcinoma de esófago se encuentran limitadas a la resección completa del tumor en estadios iniciales. Por este motivo, los pacientes con esófago de Barret son controlados periódicamente con endoscopia y obtención de biopsias con el objetivo de detectar la transformación maligna en fases precoces.
Los factores que justifican la realización de un protocolo de vigilancia son el sexo masculino, historia de enfermedad por reflujo gastroesofágico (ERGE) sintomático prolongada, tabaquismo continuo y presencia de úlcera péptica en la endoscopía.
La frecuencia de endoscopías de vigilancia en pacientes con esófago de Barret documentado depende de los datos endoscópicos iniciales.
Se recomienda (*):
DISPLASIA DE ALTO GRADO: seguimiento estrecho cada tres meses asociado a la terapéutica que el médico considere más conveniente para ese caso particular.
DISPLASIA DE BAJO GRADO: endoscopía de seguimiento a los seis y doce meses en el primer año, y cada año hasta que no se encuentre displasia en dos endoscopías anuales consecutivas.
ESÓFAGO DE BARRET SIN DISPLASIA: dos exámenes biópsicos en el primer año y luego cada tres años.
Estos últimos dos casos deben recibir en el intervalo entre las endoscopías terapia médica con inhibidores de bomba de protones por un período mínimo de tres meses antes de repetir la endoscopía. Puede ser necesario incrementar la terapia para asegurar que hay un óptimo control del reflujo.
(*) WANG, KENNETH K.; SAMPLINER, RICHARD E. Updated Guidelines 2008 for the Diagnosis, Surveillance and Therapy of Barrett’s Esophagus. American Journal of Gastroenterology. 103 (2008): 788-797.
Tratamiento:
Como el esófago de Barret es una consecuencia final del reflujo y su principal riesgo es su posible malignización, el primer objetivo del tratamiento será su profilaxis, es decir, evitar que se produzca tratando adecuadamente la enfermedad por reflujo gastroesofágico (ERGE), y el segundo, una vez establecido el esófago de Barret, intentar su regresión para que no evolucione hacia malignidad o al menos, tratar de detener su progresión.
• Tratamiento profiláctico:
La profilaxis del esófago de Barret, que supondría un diagnóstico precoz y un tratamiento eficaz de la enfermedad por reflujo gastroesofágico (ERGE), al menos en teoría, podría reducir su incidencia de manera importante y, por lo tanto, su progresión a Adenocarcinoma. La esofagitis por reflujo es el primer eslabón en la progresión de la enfermedad hacia el esófago de Barret. Esta progresión sólo puede evitarse haciendo que el material refluido pierda su agresividad o que no se produzca el reflujo. Lo primero se consigue con tratamiento médico y lo segundo, con medidas quirúrgicas.
El tratamiento médico incluye una serie de medidas higiénico-dietéticas comunes a todos los pacientes, como evitar el tabaco, los alimentos ricos en grasas, café, chocolate, alcohol, menta, jugo de naranja y determinados medicamentos (anti colinérgicos, bloqueadores de canales de calcio y otros relajantes de músculo liso); también se debe evitar la ingestión de grandes cantidades de líquidos con las comidas, bajar de peso, elevar la cabecera de la cama de 10 a 12 cm y eliminar los factores que aumenten la presión intraabdominal. La utilización de uno u otro medicamento o su combinación (procinéticos, antiácidos, protectores, antiH2 ó inhibidores de la bomba de protones), así como su dosificación, dependerá del grado de esofagitis y de las circunstancias de cada caso individual. Debe tenerse en cuenta que una vez abandonado el tratamiento, es frecuente la recidiva, por lo que debe recordarse que el tratamiento conservador debe llevarse de por vida.
La cirugía antirreflujo se reserva solo para los pocos casos en los que fracasa el tratamiento médico o en circunstancias individuales especiales. La cirugía laparoscópica, por su mejor relación costo-beneficio, puede ser una buena alternativa de tratamiento a la cirugía general. Actualmente se cuenta con una nueva técnica para tratar el enfermedad por reflujo gastroesofágico (ERGE), la Sutura Endoscópica, la que supone una terapéutica más cómoda y segura, aunque no se encuentra al alcance de todos los pacientes debido a su elevado costo. Actualmente, faltan resultados de estudios a largo plazo para poder definir cuál es el método más beneficioso.
En determinadas bibliografías se menciona la posibilidad de realizar quimioprofilaxis con inhibidores de la COX-2 no selectivos (ácido acetilsalicílico) para disminuir la incidencia de cáncer de esófago (1). Esta terapéutica demostró una reducción del riesgo de 0.57 de progresión a Adenocarcinoma (2). La estrategia se basa en la evidencia de una expresión excesiva de la COX-2 en el tejido metaplásico (3), la cual se relaciona con la adaptación de la mucosa inflamada o lesionada y su proporción aumenta de manera progresiva a lo largo de la secuencia metaplasma-displasia-cáncer (4,5). Nivel de evidencia II, grado de recomendación A.
(1) Thun MJ. NSAIDs and esophageal cancer: ready for trials but not yet broad clinical application. Gastroenterology 2003;124:246-257 en Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121..
(2) Corley DA, Kerlikowske K, Verma R, et al. Protective association of aspirin /SAIDs and esophageal cancer: a systematic review and metaanalysis.. Gastroenterology 2003;124:47-56 en USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121..
(3) Abdalla SI, Lao-Sirieix P, Novelli MR, et al. Gastrinnduced cyclooxygenase 2 expression in Barrett’s carcinogenesis. Clin Cancer Res 2004;10:4784-92 en . USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121.
(4) Morris CD, Armstrong GR, Bigley G, Green H, Attwood SE. Cyclooxygenase-2 expression in the Barrett’s metaplasia-dysplasia-adenocarcinoma sequence. Am J Gastroenterol 2001;96:990-996 en USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121..
(5) Souza RF, Shewmake K, Beer DG, Cryer B, Spechler SJ. Selective inhibitionof cyclooxygenase-2 suppresses growth and induces apoptosis in human
esophageal adenocarcinoma cells. Cancer Res 2000;60:5767-72 en . USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121.
Tratamiento específico del esófago de Barret:
El tratamiento del esófago de Barret persigue conseguir la regresión o evitar la progresión de la enfermedad utilizando varios métodos disponibles.
Los tratamientos disponibles incluyen las drogas frenadoras de la acidez gástrica, la cirugía, la ablación de la mucosa por distintas técnicas o la combinación de varios procedimientos.
La selección del método terapéutico a utilizar debe ser individualizada y dependerá de la experiencia disponible en el centro médico, las preferencias del paciente y la experiencia del médico tratante (*). Grado de recomendación B.
(*) WANG, KENNETH K.; SAMPLINER, RICHARD E. Updated Guidelines 2008 for the Diagnosis, Surveillance and Therapy of Barrett’s Esophagus. American Journal of Gastroenterology. 103 (2008): 788-797.
• Tratamiento médico:
Los objetivos son lograr alivio sintomático y principalmente, intentar detener la extensión proximal de la metaplasia. Se basa en el empleo de los Inhibidores de la Bomba de Protones, los cuales se usan de manera enérgica y por tiempo prolongado. Estudios realizados in Vitro en cultivo de células con metaplasia muestran que, tras normalizar la exposición esofágica al ácido, se reduce la inflamación del tejido y la progresión a displasia y adenocarcinoma (*). El alivio sintomático por sí sólo no constituye evidencia suficiente de bloqueo ácido adecuado y se recomienda pHmetría de 24 horas, intratratamiento, para ajustar las dosis hasta lograr una normalización de la exposición ácida del esófago, requiriéndose habitualmente dosis de Omeprazol de entre 40 y 80 mg/día.
(*) OUATULASCAR R, FITZGERALD RC, TRIADFILOPOULOS G. Differentiation and proliferation in Barrett’s esophagus and the effects of acid suppression. Gastroenterology 1999;117:327-5 en USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121.
El tratamiento médico controla los síntomas del esófago de Barret, que son los mismos de enfermedad por reflujo gastroesofágico (ERGE), pero no hay evidencia convincente demostrativa de que la normalización de la exposición esofágica al ácido reduzca el riesgo de cáncer en personas con esófago de Barret. Algunas observaciones muestran que la regresión parcial de la metaplasia por la supresión del reflujo ácido mediante de IBP sugeriría un efecto profiláctico de esta medicación (*)(**). Nivel de evidencia III, grado de recomendación D.
(*) Peters FT, Ganesh S, Kuipers EJ, et al. Endoscopic regression of Barrett’s o esophagus during omeprazole treatment; a randomized double blind study.
Gut 1999;45:489-494 en USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121..
(**) Wilkinson SP, Biddlestone L, Gore S, Shepherd NA. Regression of columnarlined (Barrett’s) oesophagus with omeprazole 40 mg daily: results of 5 years of continuous therapy. Aliment Pharmacol Ther 1999;13:1205-1209 en . USCANGA DOMÍNGUEZ, LUIS [et al]. Guía de tratamiento del esófago de Barret. Tratamiento médico, quirúrgico y endoscópico. Rev Gastroenterol Mex. 75(1) (2010): 118-121.
En general, se acepta que el empleo de IBP a largo plazo es efectivo en pacientes con esófago de Barret.