ANEXO G. EVIDENCIAS FOTOGRÁFICAS
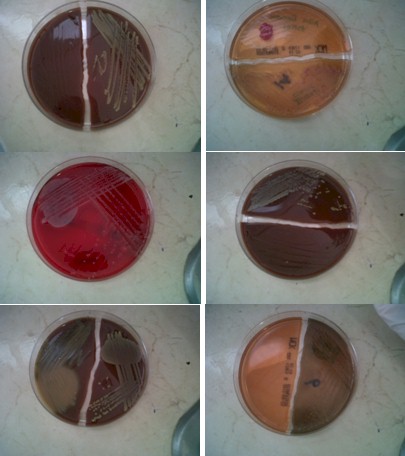
CULTIVOS POSITIVOS A IDENTIFICAR
Figuras 13. Autor: Katina Rivera Olave, Sandra Bolívar Navarro Y Gustavo Díaz Oñate.
ANEXO H. FUNDAMENTO DE EQUIPO AUTOMATIZADO UTILIZADO VITEK ®
Sistema automatizado para la identificación y pruebas de susceptibilidad Tarjetas VITEK están listas para usar, y están diseñados para su identificación o las pruebas de sensibilidad utilizando el sistema VITEK. Son porciones individuales, que garantice que las pruebas están perfectamente conservadas antes de su uso. No más grande que una tarjeta de crédito, no son difíciles de guardar o eliminar. Después de la inoculación, se sellan herméticamente y por lo tanto se puede manejar sin ningún riesgo de contaminación.
VITEK identificación
Cada tarjeta de identificación de un total de 30 pozos que contienen sustratos bioquímicos en una forma deshidratada. No hay reactivos adicionales son necesarios, eliminando así cualquier riesgo de omisión o error. La identificación VITEK abarca más de 300 especies encontradas clínicamente, y en el campo industrial.
Figura 14. Autor Ramirez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
Antibiograma
El antibiograma es la prueba microbiológica que se realiza para determinar la sensibilidad de una colonia bacteriana a un antibiótico o grupo de antibióticos.
El antibiograma, una vez realizado, da la siguiente información:
Grado de sensibilidad de la colonia bacteriana a un determinado antibiótico. Diferencia de sensibilidad por parte de la colonia a diferentes antibióticos. Con esta información, se clasifica el efecto del antibiótico sobre esa determinada colonia en: Resistente (R), Intermedio (I) y Sensible (S). En el ámbito clínico, el estudio sobre la bacteria causante de la infección y sobre el antibiograma es entregado al médico responsable del paciente. Este último es quien se encarga de decidir el tipo de antibiótico adecuado, dependiendo de los resultados del antibiograma y de otros factores procedentes del paciente, como por ejemplo una alergia a la penicilina.
Tipos de antibiograma
Disco difusor
En una placa de Petri, se siembra la bacteria por “siembra en césped” para que esta pueda crecer de manera homogénea por toda la placa. Acto seguido, se colocan los discos difusores, unas pequeñas cápsulas que contienen antibiótico, que liberan al medio. Las placas se incuban y pasado el tiempo pertinente (varía según la especie de bacteria) se observa. Las bacterias habrán crecido por toda la placa salvo en las zonas impregnadas con el antibiótico.
Dado que la concentración de antibiótico es menor a mayor distancia del disco difusor, llegará un momento en que la bacteria crecerá tolerando la ínfima concentración de antibiótico. A esta distancia se le denomina “radio de inhibición”.
Las propias empresas farmacéuticas que distribuyen los discos difusores tabulan, en centímetros, el radio de inhibición que debería provocar tal antibiótico para ser considerado Sensible, Intermedio o Resistente. El bacteriólogo se ocupa de medir con regla el radio y considerarlo según las tablas.
Sensibilidad bacteriana a los antibióticos
La determinación de la Concentración Inhibidora Mínima (CIM) es la base de la medida de la sensibilidad de una bacteria a un determinado antibiótico. La Concentración Inhibidora Mínima (CIM) se define como la menor concentración de una gama de diluciones de antibiótico que provoca una inhibición de cualquier crecimiento bacteriano visible. Es el valor fundamental de referencia que permite establecer una escala de actividad del antibiótico frente a diferentes especies bacterianas.
Hay diferentes técnicas de laboratorio que permiten medir o calcular de rutina, y de manera semicuantitativa, las Concentración Inhibidora Mínima (CIM) (métodos manuales y métodos automatizados o semiautomatizados). Estos diferentes métodos de rutina permiten categorizar una cierta cepa bacteriana en función de su sensibilidad frente al antibiótico probado. Esta cepa se denomina Sensible (S), Intermedia (I) o Resistente (R) al antibiótico.
Ciertas moléculas son representativas de un grupo de antibióticos. Los resultados (S, I, R) obtenidos con estas moléculas pueden ser ampliados a los antibióticos del grupo, que en ese caso no es necesario ensayar (Ejemplo: Equivalencia entre la cefalotina que se ensaya y las restantes cefalosporinas de 1ª generación que no es necesario probar, ya que el resultado puede deducirse del obtenido en la cefalotina).
Este hecho permite ensayar un número reducido de antibióticos, sin limitar por ello las posibilidades terapéuticas.
Pruebas de sensibilidad bacteriana in Vitro
Método de difusión en agar
El microorganismo a investigar se inocula en una o varias placas de agar y sobre su superficie se disponen los discos correspondientes a varios antibióticos. Se incuban las placas durante 16-24 horas a 35ºC y al cabo de este tiempo se estudia el crecimiento en ellas. Se valora el diámetro de la zona de inhibición que se forma alrededor de cada disco y se compara con las referencias oportunas publicadas por el NCCLS. Con esta referencia podemos informar si el microorganismo es Sensible, Intermedio o Resistente (S, I, R) a cada uno de los antibióticos ensayados en las placas.
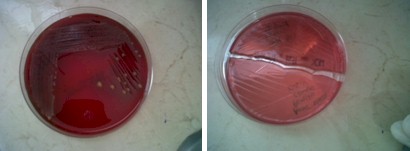
Antibiograma realizado por el método de difusión en agar
En esta fotografía se muestra un ejemplo de antibiograma realizado por el método de difusión en agar por medio de discos.
En la imagen de la izquierda se muestra una vista general de una placa con crecimiento bacteriano y con seis discos de antibióticos. La zona de color claro que ocupa la mayor parte de la placa es el crecimiento bacteriano en las zonas no inhibidas. Los círculos negros que rodean a cinco de los seis discos marcan las zonas en que los respectivos antibióticos han inhibido, con mayor o menor eficacia, el crecimiento del microorganismo a estudio. El sexto disco (AM-10) no tiene a su alrededor halo de inhibición lo que indica la resistencia del microorganismo a ese antibiótico.
La foto de la derecha, un plano más cercano de la mitad superior de la placa, permite observar con más detalle lo señalado en el párrafo anterior. Puede verse además, con gran claridad, la especial disminución de la intensidad de crecimiento del microorganismo en la zona interior del halo de inhibición del disco de CTX-30, debido probablemente a la aparición de mutantes resistentes de dicho microorganismo capaces de soportar en mayor medida que el resto el efecto inhibitorio del antibiótico.
Pruebas de sensibilidad bacteriana in Vitro
Figura 15, 16. Autor Ramirez R, Padilla J. Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
VITEK las pruebas de sensibilidad
Las tarjetas de prueba de susceptibilidad a incluir 30 o 45 pozos que contienen antibióticos deshidratados. Las pruebas específicas para detectar los mecanismos de resistencia se incluyen sistemáticamente en las tarjetas de pruebas de sensibilidad: la resistencia heterogénea (estafilococos), beta-lactamasa de amplio espectro (enterobacterias), alto nivel de resistencia a los aminoglucósidos (Enterococos), penicilinasa (estafilococos).
El sistema experto VITEK, parte del software VITEK, hace uso de BioMérieux, como saber la experiencia en las pruebas de sensibilidad y su interpretación. Todos los resultados de las pruebas de susceptibilidad son un seguimiento sistemático, interpretados y comentados por el sistema experto: la calidad de las respuestas es continuamente revisado.
HOJA DE REGISTRO DE INFORMACIÓN
N°
BACTERIA/ HONGO AISLADO
RESULTADO DEL CULTIVO
SEXO
BIBLIOGRAFÍA
Aguilar m y cols. “Factores de riesgo asociados a infecciones en diálisis peritoneal (DPCA)”. Revista de Especialidades Médico-Quirúrgicas REDALYC. Mexico. (2006). Vol. 11, Núm. 3, septiembre-diciembre, pp. 21-24. Disponible en:
http://redalyc.uaemex.mx/redalyc/pdf/473/47312479003.pdf.
Bucio j; gil T.” Gérmenes más frecuentes en peritonitis asociada a diálisis peritoneal en pacientes con insuficiencia renal crónica en el Servicio de Urgencias”. Archivos de Medicina de Urgencia de México. México (2011). Vol. 3, Núm. 1. Pag 18-23. Disponible en:
http://www.medigraphic.com/archivosdemedicinadeurgencia.
Casas D, Rodríguez E, Lizarzabal M, Fernández J. “valor de cinta reactiva para diagnostico de infecciones del liquido ascítico” revista de la sociedad venezolana de gastroenterología.(2007) Venezuela. Disponible en: www. revista de la sociedad venezolana gastroenterología.com.
De la hoz J.” Sepsis abdominal”(2009). Facultad de Medicina, Universidad Nacional. Disponible en: www.facultademedicinaunal.com
Doñate, M. Borràs, F. Coronel M, González A. Morey E. Ruiz M. Teixidor y Torguet p.” Diálisis peritoneal. Consenso de la Sociedad Española de Diálisis y Trasplante” (2006). Sociedad Española de Diálisis y Trasplante. España. Disponible en: www.Sociedad Española de Diálisis y Trasplante.com
Dupont H, Paugam-Burtz C, Muller-Serieys C, Fierobe L, Chosidow D, Marmuse JP, et al. “Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients”. ). US National Library of Medicine National Institutes of Health Disponible en:
http://www.ncbi.nlm.nih.gov/pubmed/12470095
Escalante R y Padilla J.” “Frecuencia de bacterias aisladas en líquidos peritoneales de pacientes atendidos en el servicio de nefrología del hospital nacional de niños benjamín Bloom, de marzo de 2009 a marzo de 2010” universidad del salvador, facultad de medicina. (2010). Disponible en: http://ri.ues.edu.sv/151/1/10135964.pdf
García a; García p. “Aspectos clínicos y microbiológicos de la peritonitis fúngica en diálisis peritoneal” servicio de microbiología y parasitología. Alcázar de sanjuán cuidad real (2009). Disponible en: http://www.senefro.org.
García p, Elizalde j, Valle Y.” Microorganismos más frecuentes reportados de líquido peritoneal en pacientes con peritonitis en Diálisis Peritoneal Continua Ambulatoria” Mexico (2006).
García p; y col. ”Peritonitis fúngica en diálisis peritoneal continua ambulatoria: descripción de 10 casos”. servicio de microbiología y parasitología. Alcázar de sanjuán cuidad real (2009). Disponible en: http://www.senefro.org
González A, González G, Albillos M. “Fisiopatología de la translocación y la peritonitis bacteriana espontánea en la cirrosis”. Servicio de Gastroenterología. Hospital Universitario Ramón y Cajal. (2006).
Guani E; Rojas K; Nolasco A; Aguila M; Kaji J; Rosas V. “resistencia a antibióticos de bacterias causantes de peritonitis en pacientes con diálisis peritoneal” IMBIOMED. Mexico. (2007). Disponible en:
http://www.imbiomed.com.mx/1/1/articulos.php?method=showDetail&id_articulo=51653&id_seccion=106&id_ejemplar=5232&id_revista=18.
Gurgut M; moreno A; Sitges A; Blanes M. “peritonitis y otras infecciones intraabdominales” SEIMC. España. Diponible en : SEIMC.
Huezo M; Mena E. “PERITONITIS EN DIÁLISIS PERITONEAL”. REV MED POST UNAH. (2006). VoL 4. Disponible en:
http://65.182.2.244/RMP/pdf/1999/pdf/Vol4-1-1999-14.pdf
Molina P, Puchades M, Aparicio M, García R, Miguel A.” Experiencia en peritonitis fúngica en una unidad de diálisis durante diez años”. Revista de nefrología. Valencia. (2006).
Montenegro j.” Peritonitis e infecciones del catéter en la diálisis peritoneal”. Nefrología al día. (2010). Disponible en:
http://nefrologiadigital.revistanefrologia.com/modules.php?name=libro&op=viewCap&idpublication=1&idedition=13&idcapitulo=88.
Montravers P, Dupont H, Gauzit R, Veber B, Auboyer C, Blin P, Hennequin C, Martin C.” Candida as a risk factor for mortality in peritonitis” (2006). US National Library of Medicine National Institutes of Health. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/16505648
Morales j; Arguelles J.” Peritonitis secundaria a diálisis en pacientes con insuficiencia renal crónica: reporte de seis años en un hospital de tercer nivel”. Medigraphic artemisa en línea. México D.F. (2007). Vol 64. Disponible en: www.medigraphic.com.
Muñoz e y cols. “Impacto de las peritonitis en la supervivencia a largo plazo de los pacientes en diálisis peritoneal”. Revista Nefrología. Órgano Oficial de la Sociedad Española de Nefrología. España (2011). Disponible en:
http://www.revistanefrologia.com.
Olea t, Hevia C, Bajo M, del Peso G, Selgas R; “Peritonitis por Pasteurella multocida y Candida albicans”. Nefrología. Hospital universitario. (la paz, Madrid). (2006) vol 26. Disponible en:
http://www.revistanefrologia.com/revistas/P1-E248/P1-E248-S135-A1085.pdf
Pacheco P, Barrera O, Mederos C, Pacheco D, Jiménez H, Cheng K.” Experiencias con el lavado peritoneal programado en las peritonitis difusas” Rev Cubana cir. (2007). Disponible en: www.revistacubanacir.com
Paredes J, Rivera C, Durán E, Balladares L. “Estudio bacteriológico del paciente con peritonitis debida a diálisis peritoneal continua ambulatoria en el Hospital General de México” revista mexicana Medigraphic disponible en: www.medigraphic.com.
Ramirez R, Padilla J. “FRECUENCIA DE BACTERIAS AISLADAS EN LÍQUIDOS PERITONEALES DE PACIENTES ATENDIDOS EN EL SERVICIO DE NEFROLOGÍA DEL HOSPITAL NACIONAL DE NIÑOS BENJAMÍN BLOOM, DE MARZO DE 2009 A MARZO DE 2010”. Universidad del salvador, facultad de medicina.(2010). Disponible en:
http://ri.ues.edu.sv/151/1/10135964.pdf
Rodríguez J, Castañeda T. “Gérmenes más frecuentes en peritonitis asociada a diálisis peritoneal en pacientes con insuficiencia renal crónica en el Servicio de Urgencias” medigraphic Artemisa en línea. México. (2011). Disponible en:
http://www.medigraphic.com/pdfs/urgencia/aur-2011/aur111d.pdf
Sancho-Chust JN, et al.” Achromobacter xylosoxidans como agente colonizador de bronquiectasias”. Enfermedades Infecciosas Microbiologia Clinica. 2009. doi: 10.1016 /j.eimc .2009. 02.006
Sandi m y cols. “DIÁLISIS PERITONEAL: COMPLICACIONES MAS FRECUENTES”. Revista de Posgrado de la VIa Cátedra de Medicina. (2010). Disponible en:
http://med.unne.edu.ar/revista/revista199/4_199.pdf.
Sotero S. “Complicaciones infecciosas en diálisis peritoneal crónica”. Revista Chilena de Pediatría. Chile. (2008). Disponible en:
http://www.scielo.cl/pdf/rcp/v79n5/art11.pdf.
Suarez M. “Infecciones Intraabdominales: Peritonitis y Abscesos” Revista de Medicina Interna y Medicina Crítica. Venezuela.(2007). Volumen 1, Número 4. Disponible en: www. MEDICRIT.com
Suárez G, Rubio C, García M, Martín C,. Socas M, Álamo M, López B, Cadet D, Bustos Jz, Tutosaus G y Morales M.” Presentación atípica de tuberculosis peritoneal Caso clínico diagnosticado por laparoscopia” (2007). REVISTA ESPAÑOLA DE ENFERMEDADES DIGESTIVAS. Madrid.Vol. 99. N.° 12, pp. 725-728. Disponible en: www.REVISTA ESPAÑOLA DE ENFERMEDADES DIGESTIVA.com
Úbeda A, Loza A y León C. “Peritonitis candidiásica” (2010).Servicio de Cuidados Críticos y Urgencias, Hospital Universitario de Valme, Sevilla, España. Disponible en:
http://www. elsevier. es/es/ revistas /enfermedades infecciosas microbiologia clinica 28/ peritonitis candidiasica 13188593 infecciones intraabdominales -2010